Маклейя сердцевидная (Macleaya cordata (Willd.) R. Br.), маклейя мелкоплодная (Macleaya microcarpa (Maxim.) Fedde) сем. Papaveraceae и их гибрид маклейя кьюская (Macleаya х kevensis Turill) – многолетние травянистые растения родом из Восточной Азии, широко используется в качестве лекарственного растительного сырья (ЛРС) в Китае, России, США и др. странах [1, 2].
ЛРС маклейи являются важным источником биологически активных соединений (БАВ) – изохинолиновых алкалоидов, которых содержится в маклейе более 140 соединений, относящимся к группам бензофенантридина, протоберберина, протопина и др. (сангвинарин, хелеритрин, протопин, берберин, 6-гидроксиметил-7,8-демилендигидрохелеритрин, 6-гидроксиметилдигидросангинарин, нандазурин, гидроксихелидонин, капауридин, (-)-дицентрин, лептопин, адлумидин, такатонин, (2,3)-транс-N-(п-гидроксифенетил)феруламид, 9-этоксиаристололактам, таликминин, касситидин, ацетилизокоринолин, оксинитидин, криназиатин, зантоксилин и 7,9-диметокси-2,3-метилендиоксибензофенантридин, 2,3-метилендиокси-7,10-диметил-7,8,9,10-тетрагидробензохинолин, 2,3-метилендиокси-7,10-диметил-8-карбоксилбензохинолин и др.) [3-5]. Из надземной части маклейи были выделены энантиомерные димеры алкалоидов, (±)-маклеаинов А (1) и В (2), представляющих собой продукт димеризации двух разных типов алкалоидов через σ-связь C–C. [6]
Также в ЛРС содержатся фенилпропаноиды, флавоноиды, терпеноиды, стероиды, органические кислоты и др. [2, 7, 8].
Важность исследуемого ЛРС подтверждает объем мирового рынка экстрактов маклейи, который в 2022 году составил 34 млн долл. США, а к 2031 году, по прогнозам, он достигнет 113,78 млн долл. США, что соответствует среднегодовому темпу роста в 14,4% в течение указанного периода [9].
В России ЛРС маклейи используется используются для получения лекарственного препарата противовоспалительного и противомикробного действия «Санвиритрин», действующими веществами которого являются сумма хелеритрина и сангвинарина бисульфатов, [6], за рубежом представлены экстракты «Macleaya cordata extract» CAS 112025-60-2 (смесь хелеритрина и сангвинарина хлоридов с содержанием 35%, 60%, 80%), «Sangrovit» (содержание суммы четырех алкалоидов сангвинарина, хелеритрина, протопина и аллокриптопина - 1,25%, из них 0,5% сангвинарина), «Sanguirisal» (смесь хелеритрина и сангвинарина салицилатов) и др. [10, 11].
Экстракты маклейи, содержащие хелеритрин и сангвинарин, обладают широким спектром фармакологического действия – противовоспалительным, противомикробным, антиоксидантным, проапоптотическим, противоопухолевым, инсектицидным, фунгицидным [12-15].
Выделенные из маклейи сердцевидной алкалоиды протопинового типа на модели воспаления кишечника у мышей, вызванного липополисахаридами, обуславливают различные терапевтические эффекты, приводящие к улучшению морфологии кишечника, увеличению содержания бокаловидных клеток кишечника, снижению уровня провоспалительных цитокинов, восстановлению микрофлоры [16].
Экстракты и алкалоиды маклейи перспективны для применения не только в качестве лекарственных средств, но и в качестве кормовых добавок в аквакультуре, зоотехнологии, птицеводстве и др. [10, 16-21]. Экстракт маклейи сердцевидной - потенциальный антибиотик, его прием улучшает состояние эпителия желудочно-кишечного тракта и гуморальную реакцию у коз [22]; улучшает состояние кишечника, микробиоту кур-несушек и качество яиц [23]. Выявлено защитное действие изохинолиновых алкалоидов маклейи сердцевидной на липополисахарид-индуцированное повреждение печени у птиц [24].
Преимуществом экстракта маклейи является отсутствие токсичности, генотоксичности, мутагенности и тератогенности [25]. Выявлена стабильность сангвинарина и хелеритрина из маклейи сердцевидной в метаноле и этаноле, в воде при температуре ниже 54 °C; сангвинарин стабилен при pH 2,5 - 7,0, а хелеритрин - при pH 2,5 - 8,0; оба алкалоида нестабильны в водопроводной воде и при взаимодействии с окислителями [26].
Для качественного и количественного анализа алкалоидов маклейи используют хроматографические методы, например, метод изократической ВЭЖХ в сочетании с электрораспылительной масс-спектрометрией, высокоскоростной противоточной хроматографии, модифицированной ионной жидкостью, обращенно-фазовой ВЭЖХ с тандемной масс-спектрометрией, ВЭЖХ с тандемной квадруполь-времяпролётной масс-спектрометрией и др. [3, 4, 15, 18, 27, 28] .
Для оценки содержания суммы алкалоидов успешно применяется спектрофотометрические методы. Определение суммы бензо[с]фенантридиновых алкалоидов в пересчете на сангвиритрин проводят в метанольных и этанольных извлечениях при аналитической длине волны 452 нм [29-31] и 332±3 нм [32].
В настоящее время содержание суммы сангвинарина и хелеритрина в траве маклейи регламентируется требованиями ФС.2.5.0119 «Маклейи трава» - не менее 0,5 % суммы алкалоидов в пересчёте на сангвинарин + хелеритрин в сухом сырье; определение проводят после подщелачивания и экстракции оснований алкалоидов из измельченного сырья хлороформом в течение 15 ч. Количественное определение проводят с использованием 5% раствора уксусной кислоты.
В предыдущей версии ФС 42-2666-89 наряду с экстракцией хлороформом использовали ТСХ для отделения алкалоидов от сопутствующих веществ, в качестве растворителя - подкисленный метиловый спирт. Оптическую плотность растворов измеряли на спектрофотометре в изобестической точке при длине волны 452 нм.
По методике определения с экстракцией хлороформом без реэкстракции результаты будут существенно завышенными, из-за вклада пигментов в поглощение в видимой области спектра. По экспериментальной оценке вклада пигментов в оптическую плотность, таковая может увеличивать на 20-30% от собственно суммы алкалоидов.
Хлороформ с водой при рН больше 7 создает стойкие эмульсии, что значительно уменьшает точность определения и увеличивает его время из-за сложности разделения фаз, требующей использования дополнительного оборудования (центрифуги).
На извлечение алкалоидов оказывает влияние температура, при настаивании с хлороформом при комнатной температуре в течение 30 мин нельзя достичь исчерпывающей экстракции, это обстоятельство также очень сильно влияет на погрешность определения.
Использование в качестве аналитической длины волны 402 нм – дает завышенные результаты из-за соизвлекаемых вместе с алкалоидами веществ, поглощающих в этой области спектра. Пересчет содержания суммы алкалоидов на неопределенную сумму двух веществ «сангвинарин + хелеритрин» недостаточно корректный, необходимо использовать только один конкретный стандартный образец вещества или же стандартизированную субстанцию.
В процесс извлечения алкалоидов из ЛРС маклейи решающим этапом в подготовке раствора для качественного и количественного определения является их полная экстракция и максимальное отделение от других сопутствующих веществ. Поскольку большинство изохинолиновых алкалоидов и их солей является липофильными соединениями, то экстракцию можно успешно проводить спиртами (метанол, этанол, бутанол, октанол и т.д.), как длительным настаиванием при комнатной температуре, так и экстракцией при нагревании и при перемешивании [14, 26, 33-36].
Бензофенантридиновые алкалоиды из ЛРС хорошо извлекаются этанолом [11, 15, 18]. В качестве экстрагентов широко используют подкисленную воду и растворы кислот (хлористоводородной, серной, фосфорной, уксусной, муравьиной и др.) [3, 37, 38]. Алкалоиды маклейи сердцевидной успешно экстрагировали хлористоводородной кислотой 0,2 моль/л, затем алкалоидные соединения извлекали из деминерализованного экстракта органическими растворителями, после чего анализировали методом УВЭЖХ-ДМД-МС/МС [3].
Особенностью использования в качестве экстрагентов растворов кислот является то, что они наряду с алкалоидами извлекают все остальные водорастворимые соединения, но не соизвлекают липофильные соединения. Преимущество этанола в качестве экстрагента состоит в использовании нетоксичного растворителя, возможности извлекать алкалоиды как в виде солей, так и оснований, при этом полисахариды и белковые соединения не извлекаются, недостатком является извлечение большого количества примесей. Для полноты извлечения органическими растворителями, например хлороформом, и их смесями используют подщелачивание, что позволяет проводить исчерпывающую экстракцию алкалоидов в виде оснований. Следует отметить, что существенным недостатком использования хлороформа, метиленхлорида и диэтилового эфира является их способность образовывать со спирто-водными растворами стойкие эмульсии, что затрудняет определение, увеличивает его время и привносит значительную погрешность в результаты. Также хлорсодержащие экстрагенты являются токсичными и экологически опасными растворителями, характеризуются извлечением большого количества других веществ, содержащихся в растении – фенольных соединений, пигментов, углеводородов и пр. Поэтому для отделения суммы алкалоидов от сопутствующих веществ целесообразно использовать последовательные стадии экстракции - реэкстракции водно-спиртовыми, водно-кислотными растворами и органическими экстрагентами с добавлением щелочи [39, 40].
Целью работы являлась разработка методики определения количественного определения суммы сангвинарина и хелеритрина в пересчете на сангвиритрин в траве маклейи методом спектрофотометрии, а также сравнение содержания суммы алкалоидов в образцах травы разных видов сырья - маклейи сердцевидной и мелкоплодной.
Материалы и методы. Объектом исследования служили образцы травы M. cordata и M. microcarpa, выращенные на опытных полях Средне-Волжского филиала ФГБНУ ВИЛАР в 2022-23 г. и поступившие на анализ в Испытательный центр ФГБНУ ВИЛАР.
Спектры поглощения в видимой и УФ-области получали на двулучевых спектрофотометрах Cary 100 Scan (Varian, США) и Shimadzu UV-1800 (Япония); для взвешивания использовали весы аналитические Vibra Shinko Denshi, класс 2 HRT-220CE; для получения растворов мерную посуда 1-го класса точности.
Испытуемый раствор: лекарственное растительное сырье (ЛРС) меклейи измельчают до размера частиц, проходящих сквозь сито с отверстиями размером 1 мм. Около 1,0 г (точная навеска) ЛРС помещают в коническую колбу со шлифом, прибавляют 50 мл спирта 70%, взвешивают и нагревают на кипящей водяной бане в течение 1 ч. Затем колбу отсоединяют от холодильника, охлаждают до комнатной температуры, доводят до первоначального веса спиртом 70% и фильтруют через бумажный складчатый фильтр. 5 мл полученного извлечения помещают в делительную воронку, прибавляют 2 мл 10% аммиака, 10 мл этилацетата, 5 мл воды очищенной и осторожно взбалтывают в течение 1 мин. После расслоения фаз (слои должны быть прозрачны) верхний (этилацетатный) слой отделяют в химический стакан вместимостью 50 мл. Экстракцию проводят еще раз с 5 мл этилацетата, после расслоения прозрачный этилацетатный слой отделяют и помещают в тот же стакан.
Объединенные этилацетатные извлечения из стакана количественно переносят в делительную воронку, в стакан прибавляют 10 мл воды, ополаскивают и переносят в ту же делительную воронку, осторожно взбалтывают в течение 1 мин (промывают от аммиака и сопутствующих окрашенных водорастворимых веществ). После расслоения фаз, когда нижняя (водная) фаза станет прозрачной, ее сливают и отбрасывают. К этилацетатному извлечению в делительную воронку прибавляют 2 мл кислоты серной 16%, 10 мл воды очищенной и аккуратно взбалтывают в течение 2 мин (водный слой окрашивается в желтый цвет). После разделения фаз (верхняя фаза должна быть прозрачной) водное извлечение отделяют, а с этилацетатным извлечением проводят еще двукратную экстракцию с 5 мл воды каждый раз, затем этилацетатную фазу отбрасывают, а объединенную водную фазу помещают в делительную воронку, прибавляют 5 мл аммиака 25%, 10 мл этилацетата и взбалтывают в течение 1 мин. Слои должны стать бесцветными. Этилацетатное извлечение после расслоения фаз (нижняя, водная, фаза должны быть прозрачной) отделяют в круглодонную колбу вместимостью 50-100 мл, экстракцию проводят еще два раза по 5 мл этилацетата каждый раз, этилацетатные слои отделяют и помещают в ту же колбу.
Растворитель из объединенного этилацетатного извлечения отгоняют на вакуум-выпарном аппарате при температуре около 60°С до объема около 0,05 мл, в колбу к остатку прибавляют 8 мл спирта 70%, подкисленного серной кислотой, выдерживают около 2 мин при периодическом взбалтывании, затем сливают в мерную колбу вместимостью 10 мл. В круглодонную колбу прибавляют еще 2 мл спирта 70%, подкисленного серной кислотой, взбалтывают, жидкость сливают в ту же мерную колбу, доводят спиртом 70%, подкисленным серной кислотой, до метки и перемешивают.
Раствор стандартного образца (СО) сангвиритрина
Раствор СО сангвиритрина. Около 0,01 г (точная навеска) сангвиритрина (ФС 42-0198-07) помещают в мерную колбу вместимостью 50 мл, растворяют в 45 мл спирта этилового 70 %, доводят спиртом 70% до метки и перемешивают. 5 мл полученного раствора помещают в мерную колбу вместимостью 25 мл, доводят спиртом 70%, подкисленным серной кислотой до метки и перемешивают.
Измеряют оптическую плотность испытуемого раствора при длине волны 465 нм, в кювете с толщиной слоя 10 мм. В качестве раствора сравнения используют спиртом 70%, подкисленный серной кислотой. Параллельно измеряют оптическую плотность и раствора СО сангвиритрина.
Содержание суммы алкалоидов в пересчете на сангвиритрин в ЛРС в % (Х, %) вычисляют по формуле:
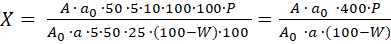 , где
, где
А0 – оптическая плотность раствора СО сангвиритрина;
А – оптическая плотность испытуемого раствора;
a0 – навеска СО сангвиритрина, г;
a – навеска сырья, г;
W- потеря в массе при высушивании, %;
Р – содержание основного вещества в СО сангвиритрина, %.
Приготовление подкисленного спирта 70%: к 6 частям (по объему) спирта 70% прибавляют 1 часть 1% раствора серой кислоты и перемешивают. Срок годности раствора 7 сут.
Приготовление 1% раствора серной кислоты: к 1 л воды прибавляют 6,1 мл концентрированной серной кислоты и перемешивают. Срок годности раствора 1 мес.
Результаты и обсуждение
Бензо[с]фенантридиновые алкалоиды имеют выраженное поглощение в УФ-области, при этом вклад в суммарное поглощение вносят все остальные изохинолиновые алкалоиды и другие вещества, содержащиеся в ЛРС маклейи. Спектр поглощения в УФ-области спектра суммы алкалоидов и сангвиритрина в этиловом спирте приведен на рис.1.
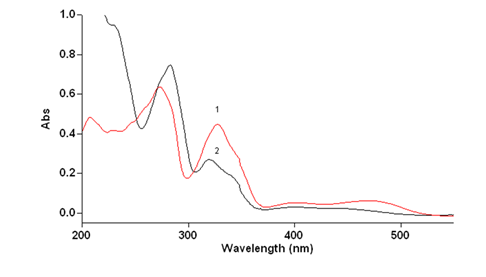
Рисунок 1.Спектр поглощения раствора СО сангвиритрина (1) и извлечения из травы маклейи (2) в спирте 70%, подкисленном серной кислотой
Для минимизации систематической и случайной погрешности определения в методике использован стандартный образец - сангвиритрин.
Близкие по структуре и свойствам четвертичные бензофенантридиновые алкалоиды сангвинарин и хелеритрин в форме оснований бесцветны, но образуют ярко-окрашенные соли. Сангвинарин с азотной или серной кислотами образует соли оранжево-красного цвета, хелеритрин - желтого.
Выраженная интенсивность поглощения сангвиритрина в спирте 70%, подкисленном серной кислотой, в УФ-области, в максимумах при 273 и 327 позволяют использовать это свойство для оценки содержания всей суммы алкалоидов в пересчете на сангвиритрин, как в виде солей, так и оснований, но определить сумму только сангвинарина и хелеритрина не представляется возможным, т.к. значения оптической плотности и результаты будут сильно завышены.
Определение суммы сангвинарина и хелеритрина целесообразно проводить по поглощению в диапазоне 350-500 нм, по максимумам поглощения их окрашенных солей. Эта особенность позволяет отделить их от других неокрашенных солей изохинолиновых алкалоидов маклейи, например, протопина и алокриптопина, которые также содержатся в сырье и вносят значительные вклад в поглощение в УФ-области.
В качестве растворителя для приготовления испытуемого раствора используют спирт 70%, подкисленный серной кислотой, рабочая концентрация раствора сангвиритрина составила 0,004 % (0,04 мг/мл). Спектр сангвиритрина в диапазоне длин волн от 350 до 550 нм характеризуется максимумами при длине волны 402 и 465 нм, последний целесообразно использовать в качестве аналитического, т.к. таковой при 402 нм может давать завышенные результаты за счет вклада сопутствующих компонентов.
Извлечения из травы маклейи имеет максимум при длине волны 402±2 и максимум или плечо при 465±2 нм. Поэтому измерение целесообразно проводить в видимой части спектра, при длине волны 465 нм, специфичной для сульфатов сангвинарина и хелеритрина (рис.2)
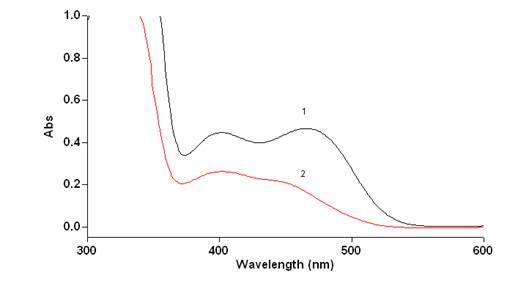
Рисунок 2. Спектр поглощения раствора СО сангвиритрина (1) и извлечения из травы маклейи (сумма алкалоидов) в спирте 70%, подкисленном серной кислотой (2)
Разработка методики с использованием метода спектрофотометрии при анализе бензо[с]фенантридиновых алкалоидов для получения точных и воспроизводимых результатов нуждается в таких условиях, при которых на интенсивность поглощения в аналитическом максимуме не оказывали сопутствующие вещества, соизвлекаемые с анализируемыми алкалоидами. В связи с этим, важным этапом разработки методики стал подбор условий экстракции, которые позволили бы исключить токсичные растворители, сократить время определения, а также оптимизировать точность и воспроизводимость. Использование органических растворителей может обусловить получение завышенных результатов из-за вклада соизвлекаемых окрашенных веществ в поглощение, например, каратиноидов, хлорофиллов и глубоко окрашенных димерных пигментов [34].
Хлороформ с водой и водно-спиртовыми растворами в щелочной среде создает стойкие эмульсии, что значительно уменьшает точность количественного определения алкалоидов, увеличивая время, сложность, использование дополнительного оборудования (центрифуги). На извлечение алкалоидов оказывает влияние температура, при настаивании с хлороформом при комнатной температуре в течение 30 мин нельзя достичь исчерпывающей экстракции, это обстоятельство очень сильно влияет на погрешность определения. Поэтому в методике ФС 42-2666-89 время настаивания длительно и составляет 15 ч.
Поскольку изохинолиновые алкалоиды успешно извлекаются этанолом, то в качестве экстрагента использован 70% этиловый спирт. Экстракцию проводили при соотношении сырье – экстрагент 1:50 при нагревании на кипящей водяной бане. Полученное извлечение подщелачивали аммиаком и основания алкалоидов экстрагировали этилацетатом. Для избавления от сопутствующих веществ проводили реэкстракцию подкисленной водой и вторую экстракцию этилацетатом. Последовательная реэкстракция оказывает значительнее влияние на результаты, по экспериментальным оценкам оптической плотности, сопутствующие алкалоидам окрашенные вещества, поглощающие в аналитической области, могут увеличивать оптическую плотность на 20-30% от поглощения собственно суммы алкалоидов.
В качестве аналитической выбрана длина волны 465 нм. Анализ сырья, поступающего в ВИЛАР, показал, что содержание суммы сангвинарина и хелеритрина (бисульфатов) варьирует в значительных пределах (от 0,08 % до 1,35 %), что в значительной степени согласуется с результатами анализов некоторых образцов травы маклеи по методике ФС 42-2666-89 (содержание суммы алкалоидов в пересчете на сангвиритрин составило 0,07 - 1,04%). Такое сырье с относительно невысоким содержанием суммы алкалоидов пригодно для переработки, поэтому целесообразно изменить норму содержания алкалоидов на соответствующую реальным показателям, т.е. не менее 0,08%.
В соответствии с требованиями ГФ ХV для разработанной аналитической методики определены валидационные характеристики. Определение линейности проводилось на 10 уровнях концентраций СО сангвиритрина в диапазоне 8,5 – 77 мкг/мл (Рис. 3), линейная зависимость имеет вид y=0,0111x-0,0622
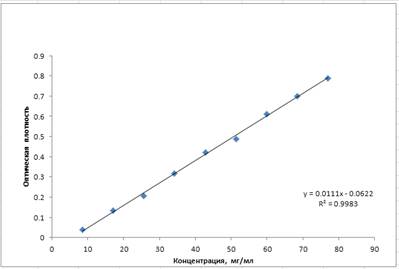
Рисунок 3. График зависимости оптической плотности от концентрации сангвиритрина
Зависимость оптической плотности от концентрации СО сангвиритрина прямо пропорциональна в диапазоне концентраций 8,5 – 77 мкг/мл, коэффициент корреляции близок к единице (0,9983), что служит критерием для подтверждения линейности.
Испытания по определению правильности методики количественного определения суммы сангвинарина и хелеритрина (бисульфатов) в пересчете на сангвиритрин в траве маклейи проводили на извлечении из ЛРС с добавлением известного количества СО сангвиритрина. Модельные смеси готовили трех концентраций с содержанием СО сангвиритрина 25, 50, 75 % к исходной концентрации в сырье маклейи (Табл. 1).
Таблица 1. Результаты испытания по определению правильности методики количественного определения суммы сангвинарина и хелеритрина (бисульфатов) в пересчете на сангвиритрин в траве маклейи сердцевидной
|
№ п/п |
Найдено, мг |
Добавлено СО, мг |
Заданное значение, мг |
Полученное значение, мг |
Абсолютная ошибка |
Выход, % |
|
1.1 |
0,2886 |
0,0512 |
0.3398 |
0.3388 |
-0.0010 |
99.71 |
|
1.2 |
0,2886 |
0,0512 |
0.3398 |
0.3365 |
-0.0033 |
99.03 |
|
1.3 |
0,2886 |
0,0512 |
0.3398 |
0.3351 |
-0.0047 |
98.62 |
|
2.1 |
0,2886 |
0,1024 |
0.3910 |
0.3916 |
+0.0006 |
100.15 |
|
2.2 |
0,2886 |
0,1024 |
0.3910 |
0.3911 |
0.0001 |
100.03 |
|
2.3 |
0,2886 |
0,1024 |
0.3910 |
0.3896 |
-0.0014 |
99.64 |
|
3.1 |
0,2886 |
0,1536 |
0.4422 |
0.4408 |
-0.0014 |
99.68 |
|
3.2 |
0,2886 |
0,1536 |
0.4422 |
0.4412 |
-0.0010 |
99.77 |
|
3.3 |
0,2886 |
0,1536 |
0.4422 |
0.4421 |
-0.0008 |
99.98 |
|
Среднее значение процента восстановления, % |
99,62 |
|||||
В разработанной методике процент восстановления находился в пределах от 99,79% до 100,33% и имеет среднее значение 99,62%, что соответствует требованиям критерия приемлемости. Сходимость (прецизионность) разработанной методики устанавливали на двух различных образцах ЛРС в пяти повторностях в одной и той же лаборатории одним и тем же аналитиком с использованием одного и того же оборудования и реактивов, в пределах одного рабочего дня (Табл. 2).
Таблица 2. Результаты испытания по определению сходимости методики количественного определения суммы сангвинарина и хелеритрина (бисульфатов) в пересчете на сангвиритрин в траве маклейи сердцевидной и маклейи мелкоплодной
|
Повторность |
Содержание суммы солей сангвинарина и хелеритрина в пересчете на сангвиритрин в траве маклейи, % |
|
|
Маклейя сердцевидная |
Маклейя мелкоплодная |
|
|
1 |
0.294 |
0.188 |
|
2 |
0.285 |
0.186 |
|
3 |
0.291 |
0.181 |
|
4 |
0.293 |
0.188 |
|
5 |
0.289 |
0.184 |
|
Среднее значение |
0,290 |
0.185 |
|
Стандартное отклонение (SD) |
0.0036 |
0,0030 |
|
Относительное стандартное отклонение (RSD), % |
1.23 |
1,60 |
Относительное стандартное отклонение составило 1,23 и 1,60%, что свидетельствует о прецизионности методики в условиях повторяемости.
Внутрилабораторная воспроизводимость методики подтверждалась на одном и том же образце ЛРС маклейи в трех повторностях на разных спектрофотометрах. Полученные результаты приведены в Табл. 3.
Таблица 3. Результаты испытания по определению воспроизводимости методики количественного определения суммы суммы сангвинарина и хелеритрина (бисульфатов) в пересчете на сангвиритрин в траве маклейи сердцевидной
|
Прибор |
Повторности |
Содержание суммы солей сангвинарина и хелеритрина в пересчете на сангвиритрин в траве маклейи, % |
|
1 |
1 |
0,294 |
|
2 |
0.285 |
|
|
3 |
0.291 |
|
|
2 |
1 |
0.281 |
|
2 |
0.289 |
|
|
3 |
0.286 |
|
|
Среднее значение содержания суммы алкалоидов в анализируемом растворе, % |
0.288
|
|
|
Стандартное отклонение (SD) |
0,0046 |
|
|
Относительное стандартное отклонение (RSD), % |
1,61 |
|
Коэффициент вариации составил 0,73%, что позволяет считать внутрилабораторную воспроизводимость результатов приемлемой.
Выводы. Разработанная методика определения суммы солей сангвинарина и хелеритрина в пересчете на сангвиритрин в траве Macleaya cordata и Macleaya microcarpa, по сравнению с фармакопейной, имеет ряд преимуществ - позволяет сократить длительность анализа с более чем 15 ч до 2 ч; исключает расход токсичных растворителей (хлороформа, дихлорэтана и метанола).
Методика валидирована, экспериментально подтверждена ее специфичность (совпадение максимумов поглощения при длине волны 465±2 нм); линейность (коэффициент корреляции 0,998); правильность (процент восстановления находится в пределах от 99,79% до 100,33%, среднее значение 99,62%), относительная погрешность среднего результата разработанной методик не превышает ±3,5 %.
Сравнение содержания суммы алкалоидов в образцах ЛРС разных видов маклейи показало, что содержание суммы солей сангвинарина и хелеритрина в пересчете на сангвиритрин в Macleaya cordata выше более чем в полтора раза, чем в Macleaya microcarpa.
Конфликт интересов
Библиографическая ссылка
Копытько Я.Ф. РАЗРАБОТКА ЭКСПРЕССНОЙ МЕТОДИКИ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ СУММЫ САНГВИНАРИНА И ХЕЛЕРИТРИНА (БИСУЛЬФАТОВ) В ПЕРЕСЧЕТЕ НА САНГВИРИТРИН В ТРАВЕ МАКЛЕЙИ МЕТОДОМ СПЕКТРОФОТОМЕТРИИ // Научное обозрение. Химические науки. 2025. № 1. ;URL: https://science-chemistry.ru/ru/article/view?id=64 (дата обращения: 04.02.2026).
 science-review.ru
science-review.ru