Введение
Основная часть перерабатываемых месторождений цветных металлов, содержащих медь, никель, свинец, цинк, находится в сульфидной форме. При пирометаллургической переработке сульфидного сырья образуется большое количество сернистых газов, содержащих, в основном, сернистый ангидрид (SO2), обуславливая высокий уровень загрязнения атмосферы.
С увеличением производства металлов обострилась проблема утилизации диоксида серы. Существующие схемы утилизации диоксида серы – получение серной кислоты и элементной серы оказались малоэффективными. Так, например, для Норильска получение серной кислоты в больших количествах невозможно в связи с низкой потребностью серной кислоты в технологическом цикле комбината и невозможностью ее вывоза из-за отсутствия железнодорожного сообщения с регионом. Утилизация диоксида серы путем получения элементной серы требует значительных затрат.
Практика переработки медно-никелевого сырья показывает, что удаление пирротина является самым дешевым способом снижения затрат, связанных с утилизацией диоксида серы. С пирротином в металлургические переделы поступает около половины серы, впоследствии требующей утилизации.
Возможности снижения количества серы, поступающей на плавку с медным концентратом, невелики, так как он на 80% состоит из халькопирита. При получении 30% медного концентрата вместо 28% масса серы, поступающей на медный завод Норильска, сократится только на 24 тыс. т/год. Основной резерв сокращения количества серы связан с никелевым концентратом, поступающим на НМЗ. Содержание в нем пирротина достигает 55%.
Задачей работы явилось снижение содержания серы в рудах или концентратах содержащих халькопирит за счет его разложения.
Теоретический анализ, материалы и методика эксперимента
Наиболее полное взаимодействие в системе медь – железо - сера отражено в работе [1]. Термические свойства сульфидов меди и железа в сечении диаграммы медь – железо - сера рассмотрены в [2] с представлением ее зависимости в координатах lgAS - 1/Т. Основные трехкомпонентные минералы в этой системе представлены халькопиритом, борнитом, идаитом, а так как все сульфидные превращения этих минералов взаимосвязаны, для исследований были выбраны образцы природного халькопирита.
Сульфидирование халькопирита элементной серой описывается реакциями [3]:
5CuFeS2 + 2S = Cu5FeS4 + 4FeS2, (1)
1,1Cu5FeS4 + 2,3S = Cu5,5FeS6,5 + 0,1FeS2, (2)
Cu5,5FeS6,5 + S = 5,5CuS + FeS2. (3)
При взаимодействии халькопирита с серой наблюдается тенденция обогащения медьсодержащих минералов по меди (CuFeS2 ®Cu5FeS4 ®Cu5,5FeS6,5®CuS) и обеднение их по железу. Термодинамически реакции (1-3) практически все прекращаются свыше 773К [3]. Поэтому область исследуемых температур лежала внутри этого интервала.
В ранее проведенных работах проделаны исследования по взаимодействию борнита с элементной серой. По данным мессбауэровского и рентгенофазового анализов получено, что конечными продуктами взаимодействия явились сульфиды меди и железа. Равновесное давление серы при этом, рассчитанное из диаграмм lgAS - 1/Т, составляло менее 0,002 атм. В этой же работе рассмотрено взаимодействие серы с медными концентратами ЦРФ и медно-никелевыми штейнами. Здесь же показано, что в концентратах и штейнах борнит под действием серы разлагается с образованием пирита.
Образцы природного халькопирита представляли собой кубики размером 5×5×5 мм. Опыты проводили в кварцевой безградиентной трубчатой печи в атмосфере аргона. Обработку образцов халькопирита жидкой серой делали при 573, 623 и 673К в течение от одного до пяти часов. В печь, стабилизированную при одной из этих температур, опускали длинный тигель с серой. После ее плавления и нагрева до заданной температуры в нее опускали на подвесах кубики халькопирита. Поправку на неизотермичность не учитывали, т.к. время обработки было достаточно большое. При выдержке от одного до пяти часов образцы вынимались с интервалом один час. Для проведения дальнейших анализов делали срез по глубине образца с последующей полировкой и травлением. Распределение железа, меди и серы по поверхности шлифа образца исследовали на электронном растровом микроскопе Comebax CX-50[1] с одновременной съемкой исследуемого шлифа методом фазового контраста. Размер исследуемой поверхности составляла 256х256 мкм.
Расшифровка исследуемых фаз проводилась методом фазового контраста (рисунок 1).
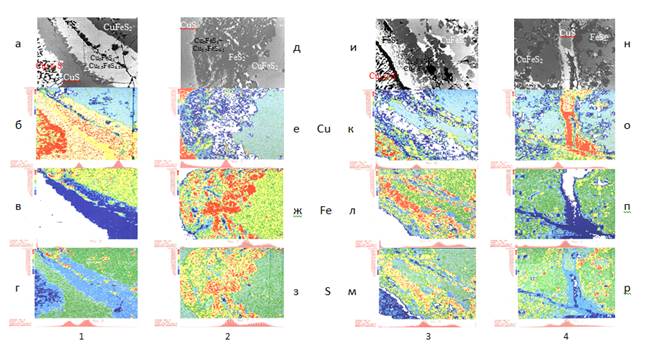
Рисунок 1. Снимки шлифов образцов халькопирита обработанных серой при различных условиях 1, 2, 3, 4, получены методом фазового контраста – а, д, и, н.
Распределение концентраций по поверхности шлифов образцов: меди – б, е, к, о; железа – в, ж, л, п; серы – г, з, м, р. (размер исследуемого участка 250х250 мкм.)
В зависимости от условий опытов (1, 2, 3, 4) получены снимки фазового контраста (рисунок 1 а, д, и, н) и распределения концентраций исследуемых элементов по поверхности шлифа (рисунок 1 б, е, к, о, в, ж, л, п, г, з, м, р). Концентрация элемента в данной точке снимка определялась по 16-ти бальной цветной шкале (слева от снимков): максимальной соответствует – красный цвет, минимальной - синий и практическое полное отсутствие указанного элемента – белый.
Опыты по обработке халькопирита серой дали результаты не только прохождения реакций 1 – 3, но и разделение получаемых фаз [5], что дает возможность, начиная с определенного размера получаемых фаз, разделять их методами обогащения.
Результаты исследований и их обсуждение
На рисунке 1(1а) представлен снимок образца халькопирита, полученный методом фазового контраста , и распределение концентраций меди, железа и серы (рисунок 1 б, в, г), обработанного жидкой серой при 623К в течение 4 часов (слева внизу расположен край образца). В средней части образца наблюдается прохождение реакции (1) с образованием борнита, ближе к краю реакции (2) с образованием идаита, далее идет слой ковеллина (реакция (3)). На краю образца медная фаза обеднена по сере и представляет собой джарлеит (Cu1,96S) либо халькозин (Cu2S). Пирит сконцентрировался к центру образца, а также находится мелкими вкраплениями по границе образуемых фаз. Наблюдается их дифференциация с четкими границами, хотя полного завершения реакций (1-3) нет.
На рисунке. 1(2) д-з представлены снимки образца халькопирита, обработанного серой при 673К в течение 3 часов (край образца находится слева на снимках). Пограничная зона, расположенная между сульфидом меди (слева) и халькопиритом (справа), имеет толщину 140 мкм. На границе с халькопиритом расположен, в основном, пирит отдельными включениями, размер которых достигают 85 мкм. На границе с сульфидом меди расположены борнит и идаит, т.е. реакции (1-3) полностью еще не завершены, однако размеры сульфидов меди и отдельных включений пирита позволяют предположить возможность проведения разделительной флотации. Сульфид меди представлен халькозином. Ковеллин в пограничном слое практически отсутствует.
Обработка халькопирита серой при 673К в течение 4 часов рисунок 1(3) и-м приводит к лучшей дифференциации фаз (край образца находится слева внизу). На поверхности образца концентрируется халькозин с четко выраженной границей с остальными фазами, граничащий с прослойкой мелкодисперсного борнита, идаита и пирита, представляющий собой остатки незавершенности реакций (1 - 3). Следующим идет плотный слой пирита, хорошо отделенный от халькопирита. Увеличение времени обработки приводит к лучшей дифференциации фаз халькозина и пирита, уменьшенной толщине пограничного слоя, который в предельном случае должен практически полностью исчезнуть.
При обработке халькопирита серой образование новых фаз в результате реакции (1-3) приводит к изменению объема образца, что, в свою очередь, влечет появление микротрещин вблизи реакционной зоны. На рисунке 1(4) н-р представлены снимки сульфидирования халькопирита по микротрещинам при 623К в течение 5 часов (край образца находится сверху). Трещина практически вся заполнена сульфидом меди, по границе трещины наблюдается борнит, идаит и мелкие включения образованного пирита в халькопирите размером 20-30 мкм.
В связи с широкими возможностями Мессбауэровской спектроскопии при исследовании железосодержащих фаз (с использованием источника Со57 в матрице хрома) полученные продукты реакции взаимодействия халькопирита с серой были подвергнуты мессбауровскому анализу. На рисунке 2 представлены мессбауэровские спектры халькопирита, обработанного серой при различных условиях. Спектр обработанного образца серой (рисунок 2а) - суперпозиция исходного секстета с дублетом, который идентифицирован как пирит. Борнит и идаит, ввиду их малого содержания, мессбауэровской спектроскопией не зарегистрированы. Однако нужно отметить, что пирит образуется при определенных условиях. В большинстве случаях отмечается наличие пирротина (Fe1-ХS). Структурные состояния пирротинов различны, наиболее распространены гексагональный (антиферромагнетик) и моноклинный (ферримагнетик, точка Кюри 598 К) пирротины.
Гексагональный пирротин при нормальных условиях антиферромагнетик, 0<x<0,12. Удельная намагниченность насыщения Js≤0,1 Ам2/кг, точка Кюри Тс=598 К.
Моноклинный пирротин (относительно низкотемпературный), 0,1<x<0,25, ферримагнетик, удельная намагниченность насыщения Js=16Ам2/кг, точка Кюри Тс=598 К, отмечаются и более высокие точки Кюри до 623-633 К.
Приведенный мессбауэровский спектр на рисунке 2б указывает на существование двух магнитных подрешеток находящегося в ферримагнитном состоянии пирротина, близкого к моноклинному.
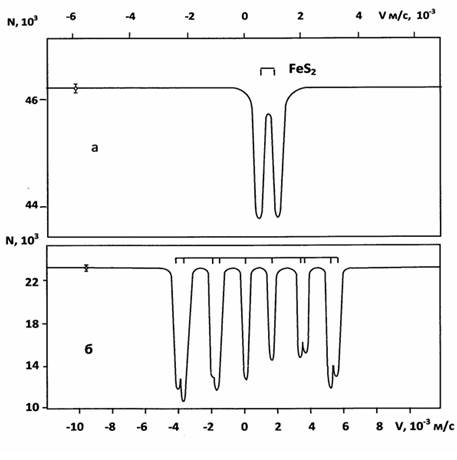
Рисунок. 2. Мессбауэровские спектры образцов халькопирита обработанных серой при различных условиях: а – пирита; б – пирротина близкого моноклинному.
Наличие значительного количества моноклинного пирротина и достаточно крупная вкрапленность минералов в рудах ряда зарубежных месторождений позволяют использовать методы магнитной сепарации. Выделение и складирование пирротина существенно упрощает технологию обогащения. В Норильских рудах присутствует в основном гексагональный пирротин и методами магнитной сепарации он не удаляется.
Рассмотрена возможность использования отходящих газов автогенных плавок сульфидных руд содержащих в основном сернистый ангидрид восстанавливая его в аптейке печи природным газом либо пылевидным углем по следующим основным реакциям:
4CH4 + 2SO2 = CO2 + 2H20 + S2, (4)
4CH4 + 6SO2 = 4 CO2 + 4H2O + 4H2S + S2, (5)
2CO + SO2 = 1/2S2 + 2CO2, (6)
COS + H2O = H2S + CO2, (7)
4H2S + 2SO2 = S6 + 4H2O. (8)
Опыты, проведенные в короткобарабанной лабораторной вращающейся печи в районе температуры 673 К по обработке халькопирита серой полученной в результате восстановления сернистого ангидрида пылевидным углем при температуре 1523 К показали, что разложение халькопирита идет по той же схеме, что и при использовании элементной серы. Коэффициент использования восстановленных газов составлял 0,6 -0,8, что позволяет предположить его увеличение при использовании длиннобарабанных вращающихся печей как в цементной промышленности.
Проведенные исследования показали, что природный халькопирит сульфидируется элементной серой либо серой восстановленных газов автогенных процессов с образованием внешнего слоя сульфида меди и внутреннего – пирротина (или при определенных условиях пирита). Причем, между этими слоями имеется промежуточный слой, состоящий из борнита и идаита, толщина которого уменьшается при увеличении времени обработки и температуры до 773К. В результате сульфидирования халькопирита серой из-за объемного изменения фаз образуются микротрещины, по которым проникает сера внутрь образца, что ускоряет процесс сульфидирования [4].
Из приведенных результатов видно, что в результате направленной диффузии серы в халькопирит, возникает разнонаправленное движение атомов двух сортов - железа и меди, направление которого совпадает с направлением диффузии серы. Данное обстоятельство можно объяснить опытами, поставленными Киркендаллом и Смайгелскесом, об относительной скорости перемещения атомов двух сортов при диффузии. В результате эксперимента ими получено, что коэффициенты диффузии разносортных атомов не равны друг другу. Это приводит к относительному разделению их в исследуемом материале. С другой стороны, исследования, проведенные по диффузии на границе зерен и дислокациям, показали, что при понижении температуры, коэффициент диффузии на границе раздела зерен и дислокациям будет уменьшаться медленнее, чем в самом зерне. Иными словами, относительный вклад диффузии по границам зерен и дислокациям при более низких температурах будет возрастать [5]. В нашем случае по границе зерен идут химические превращения разложения халькопирита, что приводит еще к большему вкладу в скорость диффузии за счет увеличения дислокаций.
При переработке медных сульфидных руд, содержащих халькопирит, предлагается следующая схема, позволяющая снизить количество сернистых выбросов, возникающих в пирометаллургическом переделе. Серосодержащие газы, получающиеся на пирометаллургическом переделе, восстанавливаются в аптейке печи и горячие подаются в агрегат (например, длиннобарабанная вращающаяся печь), где происходит сульфидирование халькопирита содержащегося в руде или концентрате. Нужную температуру в агрегате, можно, поддерживать за счет сжигания газообразного, жидкого или пылевидного топлива. Полученный продукт подвергается измельчению и флотации либо магнитной сепарации в случае получения моноклинного пирротина с целью отделения последнего. При этом возможно повысить содержание меди в концентрате до 55 – 65 % , а содержание серы уменьшается до 3 раз, включая оборотную восстановленную серу пирометаллургических плавок, за счет извлечения и удаления сульфидного железа.
Сохранение или увеличение достигнутых объемов производства товарной продукции, например, на предприятиях ЗФ ПАО ГМК «Норильский никель» возможно лишь при проведении мероприятий, обеспечивающих выбросы на уровне, заложенном в «Проект нормативов ПДВ» [6]. При сохранении объемов производства и утилизации сернистых газов на существующем уровне экологические платежи могут вырасти в 4,5 раза, что связано с переходом части выбросов из категории ВСВ в категорию сверх ВСВ. Поэтому возможность снижения серы в медных рудах или концентратах, содержащих халькопирит, за счет перевода железа халькопирита в пирротин и последующее его отделение всегда будет экономически оправдано [7].
Выводы
Найдена возможность извлечения железа и части серы из халькопирита, содержащегося в медных сульфидных рудах или концентратах, за счет его разложения под действием серосодержащих продуктов. При этом качество медного концентрата можно повысить за счет увеличения меди в концентрате до 55 – 65 %. Извлечение сульфидов железа можно осуществить, используя флотацию либо магнитную сепарацию, при переводе пирротинов в моноклинную структурную форму. Предложена схема снижения серных выбросов при переработке сульфидных медных руд или концентратах, содержащих халькопирит, с возможным снижением выбросов серы в 3 раза. С увеличением экологических платежей данная технология может быть экономически оправдана.
Библиографическая ссылка
Власов О.А., Мечев В.В., Веретнова Т.А. СНИЖЕНИЕ СЕРОСОДЕРЖАЩИХ ВЫБРОСОВ ПРИ ПЕРЕРАБОТКЕ МЕДНЫХ СУЛЬФИДНЫХ РУД СОДЕРЖАЩИХ ХАЛЬКОПИРИТ // Научное обозрение. Химические науки. 2024. № 1. ;URL: https://science-chemistry.ru/ru/article/view?id=63 (дата обращения: 04.02.2026).
 science-review.ru
science-review.ru