Введение. Исходя из принципа плотной упаковки атомов в кристаллах [1], теоретически несложно рассчитать плотность простого вещества, зная основные характеристики его атомов и представляя их в виде упругих сфер. На первый взгляд в этом нет практического смысла, поскольку в зависимости от условий кристаллизации вещество может существовать в различных кристаллических формах, плотность которых неодинакова [2, 3]. К тому же, понятие атомного радиуса, величина которого лежит в основе расчета, является весьма неопределенным. Эти соображения позволяют заключить, что рассчитанная таким образом плотность вещества может значительно отличаться от экспериментальной. Разумеется, может быть введен поправочный коэффициент К: ρэ = Кρр. Однако это имеет смысл только в том случае, если К является величиной постоянной для всех простых веществ или хотя бы для какой-либо группы веществ, на что трудно рассчитывать.
Приведенные доводы являются, по-видимому, одной из причин отсутствия интереса к проблеме корреляции значений плотности веществ, рассчитанных исходя из геометрических характеристик их атомов и полученных экспериментально. В то же время известно, что для большинства металлов реализуются структуры плотнейших или близких к плотнейшим упаковок, которые характеризуются примерно одинаковой степенью заполнения атомами объема кристаллической решетки [4]. Атомы в кристаллических решетках металлов связаны между собой химическими связями одинаковой природы, что обусловливает однотипный характер экспериментального определения их атомных радиусов и получение при этом сравнимых результатов. Это дает основание предположить, что для металлов коэффициент К при определенных условиях может приближаться к некоторому постоянному значению.
Цель исследования. Целью данной работы является обоснование предложенной методики расчета атомных радиусов металлов и других простых веществ и их соединений, обладающих плотнейшей или близкой к ней упаковкой атомов.
Материал и методы исследования. Результаты работы получены обработкой экспериментальных данных о плотности и атомных радиусах металлов, приведенных в литературных источниках, представленных в списке литературы.
Обсуждение результатов. Для всех металлов, для которых известны величины атомных радиусов, было рассчитано соотношение:

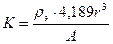 (1).
(1).
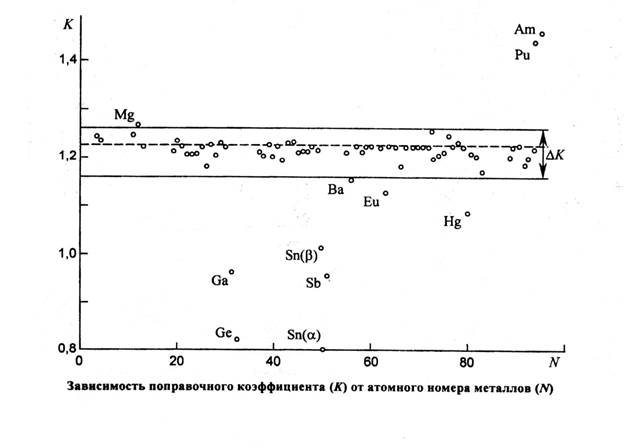
Здесь А – масса атома металла в атомных единицах массы, 4,189r3 – объем атома, представленного в виде сферы радиуса r. Использованные в расчетах значения плотности (в кг/м3) и атомного радиуса (в нанометрах) взяты из работ [5, 6]. Полученные результаты приведены в табл. 1. Их анализ показывает, что большинство значений К находится в пределах 1,16 – 1,26. Более существенные отклонения наблюдаются только для металлов в жидком агрегатном состоянии при комнатной температуре (Hg, Ga), металлов, кристаллическая структура которых не характеризуется плотнейшей упаковкой (Sn, Ge, Po, Sb) и некоторых радиоактивных металлов (Pu, Am), определение плотности и атомных радиусов которых представляет существенные трудности. Коэффициент К связан с плотностью упаковки атомов и возрастает при ее увеличении. Это подтверждается тем, что среднее значение К практически одинаково для структур типа А1 и A3, имеющих плотнейшую упаковку (74,1%) и составляет, соответственно, 1,224 и 1,227. Для структур типа А2, плотность упаковки которых ниже (68%), среднее значение меньше - 1,204. Еще меньшее значение К ~ 0,8 наблюдается для структур типа А4, плотность упаковки которых составляет 34%.
Анализ выборки, представленный на рисунке, свидетельствует, что между величиной К и атомным номером элемента не наблюдается корреляция. Около 90% всех значений К для металлов заключено в пределах ΔК = 1,16...1,26. Аппроксимация приведенных на рисунке результатов по методу наименьших квадратов дает значение К = 1,225 (из рассмотрения исключены металлы, значение К для которых выходит за пределы 1,1—1,3). Используя полученное значение К из соотношения (1), можно вывести простые формулы (2) и (3), расчет по которым атомного радиуса и плотности более удобен, чем приведенный в [7] метод расчета через число Авогадро и мольный объем:
r = 0, 664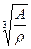 ; (2) ρ = 0,2924
; (2) ρ = 0,2924 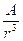 , (3)
, (3)
единицы измерения те же, что в формуле (1).
В табл. 2 приведены расчетные значения атомных радиусов металлов, полученные по формуле (2) в сравнении с экспериментально определенными значениями атомных радиусов, которые приведены в работах [5—7]. Анализ данных табл. 2 показывает, что отличие расчетных значений атомных радиусов от экспериментальных в абсолютном большинстве случаев не превышает различия между значениями атомных радиусов одного и того же металла, приведенных в используемых литературных источниках. Более того, средняя величина относительной ошибки расчетных значений атомных радиусов металлов по отношению к экспериментальным результатам (1,314%), рассчитанная по формуле:

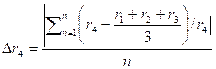 , (4)
, (4)
где величины r1, r2 и r3 — экспериментальные значения атомного радиуса (взяты из работ [2], [6], [5]); r4 – расчетное значение атомного радиуса, оказалась меньшим по сравнению с относительной ошибкой экспериментальных значений радиусов для каждого из трех используемых литературных источников по отношению к двум остальным (5,160%, 2,375%, и 1,507% для источников [5], [6] и [7] соответственно).
Таблица 1. Значения К для металлов
|
Элемент |
Атомный номер |
К |
Структура [5} |
||
|
Li |
3 |
1,247 |
А2 |
||
|
Be |
4 |
1,240 |
A3 |
||
|
Na |
11 |
1,252 |
А2 |
||
|
Mg |
12 |
1,273 |
A3 |
||
|
AI |
13 |
1,225 |
А1 |
||
|
К |
19 |
1,214 |
А2 |
||
|
Ca |
20 |
1,238 |
А1 |
||
|
Sc |
21 |
1,228 |
A3 |
||
|
Ti |
22 |
1,211 |
A3 |
||
|
V |
23 |
1,209 |
А2 |
||
|
Cr |
24 |
1,214 |
А2 |
||
|
Mn |
25 |
1,227 |
А1 |
||
|
Fe |
26 |
1,181 |
А2 |
||
|
Co |
27 |
1,236 |
A3 |
||
|
Ni |
28 |
1,211 |
А1 |
||
|
Cu |
29 |
1,239 |
А1 |
||
|
Zn |
30 |
1,227 |
A3 |
||
|
Ga |
31 |
0,962 |
Р |
||
|
Ge |
32 |
0,825 |
А4 |
||
|
Rb |
37 |
1,216 |
А2 |
||
|
Sr |
38 |
1,207 |
А1 |
||
|
Y |
39 |
1,230 |
A3 |
||
|
Zr |
40 |
1,201 |
A3 |
||
|
Nb |
41 |
1,227 |
А2 |
||
|
Mo |
42 |
1,198 |
А2 |
||
|
Tc |
43 |
1,236 |
A3 |
||
|
Ru |
44 |
1,238 |
A3 |
||
|
Rh |
45 |
1,215 |
А1 |
||
|
Pd |
46 |
1,217 |
А1 |
||
|
Ag |
47 |
1,218 |
А1 |
||
|
Cd |
48 |
1,224 |
A3 |
||
|
In |
49 |
1,220 |
Т |
||
|
Sn(α) |
50 |
0,800 |
А4 |
||
|
Sn(β) |
50 |
1,018 |
Т |
||
|
Sb |
51 |
0,961 |
Тр |
||
|
Cs |
55 |
1,214 |
А2 |
||
|
Ba |
56 |
1,152 |
А2 |
||
|
Элемент |
Атомный номер |
K |
Структура |
||
|
La |
57 |
1,229 |
A3 |
||
|
Се |
58 |
1,219 |
A3 |
||
|
Рг |
59 |
1,229 |
A3 |
||
|
Nd |
60 |
1,229 |
A3 |
||
|
Pm |
61 |
- |
- |
||
|
Sm |
62 |
1,230 |
Тр |
||
|
Eu |
63 |
1,129 |
А2 |
||
|
Gd |
64 |
1,229 |
A3 |
||
|
Tb |
65 |
1,229 |
A3 |
||
|
Dy |
66 |
1,189 |
A3 |
||
|
Ho |
67 |
1,230 |
A3 |
||
|
Er |
68 |
1,231 |
A3 |
||
|
Tm |
69 |
1,230 |
A3 |
||
|
Yb |
70 |
1,229 |
А1 |
||
|
Lu |
71 |
1,230 |
A3 |
||
|
Hf |
72 |
1,257 |
A3 |
||
|
Та |
73 |
1,200 |
А2 |
||
|
W |
74 |
1,207 |
А2 |
||
|
Re |
75 |
1,216 |
A3 |
||
|
Os |
76 |
1,250 |
A3 |
||
|
Ir |
77 |
1,229 |
А1 |
||
|
Pt |
78 |
1,237 |
А1 |
||
|
Au |
79 |
1,226 |
А1 |
||
|
Hg |
80 |
1,095 |
- |
||
|
Tl |
81 |
1,214 |
A3 |
||
|
Pb |
82 |
1,209 |
А1 |
||
|
Bi |
83 |
1,178 |
Тр |
||
|
Po |
84 |
0,669 |
К |
||
|
Fr |
87 |
- |
- |
||
|
Ra |
88 |
1,203 |
А2 |
||
|
Ac |
89 |
1,225 |
А1 |
||
|
Th |
90 |
1,230 |
А1 |
||
|
Pa |
91 |
1,185 |
A3 |
||
|
U |
92 |
1,200 |
М |
||
|
Np |
93 |
1,220 |
Р |
||
|
Pu |
94 |
1,450 |
М |
||
|
Am |
95 |
1,468 |
A3 |
||
Примечание. Все структуры стабильны при комнатной температуре: А1 — гранецентрированная кубическая; А2 — объемноцентрнрованная кубическая; A3 — гексагональная; А4 — алмазоподобная. Сингонии: К — кубическая; Т — тетрагональная; Тр — тригональная; Р — ромбоэдрическая; М — моноклинная. Для металлов с атомными номерами 96-105 расчеты не проведены из-за недостатка данных, входящих в формулу (1).
С помощью формулы (2) были рассчитаны значения атомных радиусов берклия, кюрия и прометия (табл. 2), данные об экспериментально определенных значениях атомных радиусов которых отсутствуют. Формула (3) позволила рассчитать плотность франция (rэ = 0,28 нм; ρFr = 2970,35 кг/м3), сведения о которой отсутствуют в приведенных литературных источниках, и уточнить плотность радия, которая согласно работе [5] ≈5000 кг/м3, а расчетное значение составило 5092,5 кг/м3.
Известно из работ [4, 5], что структуры плотнейшей упаковки характерны также для кристаллов инертных газов. Это позволило предположить, что расчетные формулы (2) и (3) применимы и в этих случаях. Данные табл. 3 подтверждают это предположение, за исключением гелия, определение атомного радиуса и плотности которого представляет значительные экспериментальные трудности, что делает весьма вероятной возможность ошибки. Расчетные значения атомных радиусов остальных инертных газов отличаются от экспериментальных [7] не более, чем на 0,004 нм. Экспериментальные значения плотности кристаллов инертных газов, используемые в расчетах, взяты из работы [8]. С помощью формулы (3) рассчитана плотность твердого радона (ρRn = 4681,69 кг/м3), сведения о которой отсутствуют в литературе.
Полученные зависимости можно использовать также для расчета плотности некоторых сплавов, если входящие в их состав металлы имеют близкие значения атомных радиусов. Так для сплавов типа твердых растворов замещения может быть предложена следующая формула для расчета плотности:
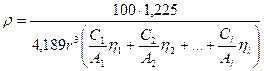 . (5)
. (5)
|
Атомный номер |
Элемент |
r1, нм ×102 |
r2, нм ×102 |
r3, нм ×102 |
r4, нм ×102 |
|
|||
|
3 |
Li |
15,70 |
15,50 |
15,20 |
15,61 |
|
|||
|
4 |
Be |
11,30 |
11,30 |
11,13 |
11,26 |
|
|||
|
11 |
Na |
19,20 |
18,90 |
18,58 |
19,07 |
|
|||
|
12 |
Mg |
16,20 |
16,00 |
15,98 |
16,00 |
|
|||
|
13 |
Al |
14,30 |
14,30 |
14,32 |
14,30 |
|
|||
|
19 |
К |
23,60 |
23,60 |
22,72 |
23,68 |
|
|||
|
20 |
Ca |
19,70 |
19,70 |
19,74 |
19,64 |
|
|||
|
21 |
Sc |
16,40 |
16,40 |
16,06 |
16,39 |
|
|||
|
22 |
Ti |
14,50 |
14,60 |
14,48 |
14,56 |
|
|||
|
23 |
V |
13,40 |
13,40 |
13,11 |
13,46 |
|
|||
|
24 |
Cr |
12,80 |
12,70 |
12,49 |
12,83-12,85* |
|
|||
|
25 |
Mn |
13,00 |
13,00 |
13,66 |
12,93-13,07* |
|
|||
|
26 |
Fe |
12,60 |
12,60 |
12,41 |
12,76 |
|
|||
|
27 |
Co |
12,50 |
12,50 |
12,53 |
12,47 |
|
|||
|
28 |
Ni |
12,40 |
12,40 |
12,47 |
12,45 |
|
|||
|
29 |
Cu |
12,80 |
12,80 |
12,78 |
12,76 |
|
|||
|
30 |
Zn |
13,90 |
13,90 |
13,32 |
13,90 |
|
|||
|
31 |
Ga |
13,80 |
- |
12,20 |
14,50 |
|
|||
|
32 |
Ge |
13,90 |
- |
13,70 |
15,86 |
|
|||
|
37 |
Rb |
25,30 |
24,80 |
24,57 |
25,37 |
|
|||
|
38 |
Sr |
12,50 |
21,50 |
21,52 |
21,61 |
|
|||
|
39 |
Y |
18,01 |
18,10 |
17,76 |
17,99 |
|
|||
|
40 |
Zr |
15,90 |
16,00 |
15,89 |
16,01 |
|
|||
|
41 |
Nb |
14,70 |
14,50 |
14,29 |
14,70 |
|
|||
|
42 |
Mo |
13,90 |
13,90 |
13,63 |
14,01 |
|
|||
|
43 |
Tc |
13,60 |
13,60 |
13,52 |
13,56 |
|
|||
|
44 |
Ru |
13,40 |
13,40 |
13,25 |
13,36 |
|
|||
|
45 |
Rh |
13,40 |
13,40 |
13,45 |
13,44 |
|
|||
|
46 |
Pd |
13,70 |
13,70 |
13,76 |
13,74 |
|
|||
|
47 |
Ag |
14,40 |
14,40 |
14,45 |
14,43 |
|
|||
|
48 |
Cd |
15,60 |
15,60 |
14,89 |
15,61 |
|
|||
|
49 |
In |
16,60 |
16,60 |
16,20 |
16,63 |
|
|||
|
50 |
Sn |
15,80 |
- |
16,20 |
16,81-18,21* |
|
|||
|
51 |
Sb |
16,10 |
- |
14,50 |
17,46 |
|
|||
|
52 |
Те |
17,00 |
- |
14,30 |
18,16 |
|
|||
|
55 |
Cs |
27,40 |
26,80 |
26,55 |
27,49 |
|
|||
|
56 |
Ba |
22,10 |
22,10 |
21,73 |
22,54 |
|
|||
|
Атомный номер |
Элемент |
r1, нм ×102 |
r2, нм ×102 |
r3, нм ×102 |
r4, нм ×102 |
||||
|
57 |
La |
18,79 |
18,70 |
18,69 |
18,77 |
||||
|
58 |
Се |
18,20 |
- |
|
18,23-18,33* |
||||
|
59 |
Pr |
18,28 |
18,20 |
18,20 |
18,38 |
||||
|
60 |
Nd |
18,21 |
- |
18,14 |
18,20-18,38* |
||||
|
61 |
Pm |
- |
- |
- |
18,04 |
||||
|
62 |
Sm |
18,04 |
- |
- |
18,02 |
||||
|
63 |
Eu |
19,84 |
20,20 |
19,95 |
20,40 |
||||
|
64 |
Gd |
18,01 |
17,90 |
17,86 |
17,99 |
||||
|
65 |
Tb |
17,83 |
17,70 |
17,63 |
17,81 |
||||
|
66 |
Dy |
17,74 |
17,70 |
17,52 |
17,72 |
||||
|
67 |
Ho |
17,66 |
17,60 |
14,43 |
17,64 |
||||
|
68 |
Er |
17,57 |
17,50 |
17,34 |
17,55 |
||||
|
69 |
Tm |
17,46 |
17,40 |
17,24 |
17,44 |
||||
|
70 |
Yb |
19,39 |
19,30 |
19,40 |
19,38 |
||||
|
71 |
Lu |
17,35 |
17,40 |
17,17 |
17,33 |
||||
|
72 |
Hf |
15,90 |
15,90 |
15,64 |
15,78 |
||||
|
73 |
Та |
14,60 |
14,60 |
14,30 |
14,71 |
||||
|
74 |
W |
14,00 |
14,00 |
13,70 |
14,08 |
||||
|
75 |
Re |
13,70 |
13,70 |
13,70 |
13,74 |
||||
|
76 |
Os |
13,60 |
13,50 |
13,38 |
13,51 |
||||
|
77 |
Ir |
13,60 |
13,50 |
13,58 |
13,58 |
||||
|
78 |
Pt |
13,90 |
13,80 |
13,87 |
13,86 |
||||
|
79 |
Au |
14,40 |
14,40 |
14,44 |
14,40 |
||||
|
80 |
Hg |
15,70 |
16,00 |
15,02 |
16,31 |
||||
|
81 |
Tl |
17,10 |
17,10 |
17,04 |
17,16 |
||||
|
82 |
Pb |
17,40 |
17,50 |
17,50 |
17,48 |
||||
|
83 |
Bi |
18,20 |
- |
15,43 |
18,45 |
||||
|
84 |
Po |
15,30 |
- |
16,70 |
18,43-18,72* |
||||
|
88 |
Ra |
23,50 |
- |
- |
23,65 |
||||
|
89 |
Ac |
20,30 |
- |
18,78 |
18,76 |
||||
|
90 |
Th |
35,90 |
18,00 |
17,97 |
17,96 |
||||
|
91 |
Pa |
16,20 |
16,20 |
16,06 |
16,39 |
||||
|
92 |
U |
15,30 |
15,30 |
13,90 |
15,41 |
||||
|
93 |
Np |
15,00 |
15,00 |
13,10 |
15,03 |
||||
|
94 |
Pu |
16,20 |
- |
15,13 |
16,47 |
||||
|
96 |
Cm |
- |
- |
- |
17,49 |
||||
|
97 |
Bk |
- |
- |
- |
17,28 |
||||
Примечание. * – Значения атомного радиуса, полученные при использовании в расчетах двух значений плотности – максимального и минимального
Таблица 3. Экспериментальные (rэ ρэ) и расчетные (rр, ρр) значения атомных радиусов и плотности инертных газов в кристаллическом состоянии
|
Элемент |
rэ, нм ×102 [7] |
rр, нм×102 |
ρэ г/см3 [8] |
ρр, г/см3 |
|
Не |
12,2 |
17,8 |
0,194 |
0,644 |
|
Ne |
16,0 |
15,8 |
1,444 |
1,441 |
|
Аг |
19,1 |
18,8 |
1,623 |
1,676 |
|
Кг |
20,1 |
20,3 |
2,826 |
3,017 |
|
Хе |
21,8 |
21,4 |
3,540 |
3,706 |
|
Rn |
22,2 |
|
- |
4,682 |
Для основного металла и растворенных металлов, радиус атомов которых совпадает с радиусом атомов основного металла η = 1. В табл. 4 приведены результаты расчетов плотности некоторых латуней. Для цинка в расчетах принято значение коэффициента η = 1,12. Сравнение полученных данных с экспериментальными свидетельствует о незначительном их различии.
Таблица 4. Экспериментальные (ρэ) и расчетные (ρр) значения плотности некоторых латуней
|
Марка |
Состав, % |
ρэ, г/см3 [9] |
ρр, г/см3 |
|
|
Сu |
Zn |
|||
|
Л96 |
96 |
4 |
8,85 |
8,85 |
|
Л90 |
90 |
10 |
8,78 |
8,77 |
|
Л85 |
85 |
15 |
8,75 |
8,75 |
|
Л80 |
80 |
20 |
8,66 |
8,70 |
|
Л70 |
70 |
30 |
8,61 |
8,63 |
|
Л68 |
68 |
32 |
8,60 |
8,60 |
|
Л63 |
63 |
37 |
8,40 |
8,57 |
Выводы. Полученные результаты могут найти применение в исследованиях атомной структуры веществ, а также позволяют в некоторых случаях уточнить экспериментально полученные значения плотности металлов и величины их атомных радиусов.
ОБОЗНАЧЕНИЯ
ρэ, ρр – экспериментальная и расчетная плотность вещества; А – атомная масса металла; К – поправочный коэффициент; r – атомный радиус металла, кристаллическая решетка которого сохраняется в сплаве (растворитель); С1 С2, ... Сi – концентрация металлов, входящих в состав сплава; А1, А2, ... Аi – атомные массы металлов; η1, η2,... ηi – поправочные коэффициенты, учитывающие искажение кристаллической решетки за счет различия радиусов атомов растворенного металла и растворителя.
 science-review.ru
science-review.ru